Dieser Artikel begründet, warum der Phasenwinkel der BIA die Bestimmung von Änderungen der zellulären Vitalität ermöglicht. Dadurch können Behandlungen, Gaben von Vitalstoffen oder Trainingseffekte sichtbar werden. Doch wie gut und auf welche Art sind Änderungen des Phasenwinkels tatsächlich mit Änderungen der Vitalität verbunden?
Was ist Vitalität?
Bevor wir den engen Zusammenhang zwischen Phasenwinkel und Vitalität darlegen, stellt sich die Frage: Was ist Vitalität überhaupt?
Vitalität, bzw. Lebendigkeit, ist sehr eng mit dem Begriff des Lebens verbunden. Einen guten Überblick zu den vielfältigen Aspekten dieses Begriffs liefert folgender Vortrag.

Vitalität beschreibt, wie sich Lebendiges, z.B. Zellen oder Organismen entwickeln und auf Umwelteinflüsse bzw. Stress reagieren. Eine formale Definition des Begriffs der Vitalität findet sich hier im Glossar.
Neben der abstrakten Definitionen gibt es viele konkrete Phänomene als deren Ausdruck. Dazu zählen z.B. Muskelkraft, Ausdauerleistung oder der Verlauf und das Überleben von Krankheiten. Diese machen das Thema leichter verständlich und praktisch bedeutsam.
Und was ist Leben?
Für die spätere Erklärung der physikalischen Ursachen des Zusammenhangs zwischen Phasenwinkel und Vitalität müssen wir noch einmal kurz zur Frage — Was ist Leben? — zurückkehren.
Lebende Systeme haben die Fähigkeit, komplexe, mit einer hohen inneren Ordnung versehene Strukturen zu schaffen und zu erhalten. Man kann auch sagen, lebende Systeme beinhalten ein hohes Maß an Information. Diese Fähigkeit des Lebens unterscheidet sich qualitativ von unbelebten Systemen.
Das zufällige Zustandekommen komplexer Strukturen mit hohem Informationsgehalt und die Erhaltung über lange Zeit ist in der unbelebten Welt unwahrscheinlich. Zwar kann z.B.ein Kristall eine perfekte Ordnung zeigen, nur ist diese im Vergleich zu lebenden Systemen sehr einfach und beinhaltet wenige Informationen.
Provokativ gesagt ist Leben eine Eigenschaft von Systemen, hoch geordnete, komplexe Strukturen zu bilden und dabei gegen den zweiten Hauptsatz der Thermodynamik zu verstoßen. Diese Erkenntnis motivierte immer wieder Wissenschaftler, Hypothesen von einer Lebenskraft (vis vitalis) [Driesch1905] oder Negentropie [Schrodinger1951] zu diskutieren. Die Lebenskraft wäre dann die Ursache oder Triebfeder der Lebendigkeit bzw. Vitalität.
Doch was hat das alles mit unserem Phasenwinkel zu tun?
Lebendige Strukturen am Beispiel der Membranpotenziale
Beispiele für derartige lebendige Strukturen sind die Membranen der Zellen und Mitochondrien mit ihren Membranpotenzialen. Die Erzeugung dieser Membranpotenziale erfolgt durch ein komplexes Netzwerk biochemischer Vorgänge. Der Phasenwinkel der bioelektrischen Impedanzanalyse hängt wesentlich von den Membranpotenzialen ab. Warum das so ist und wie das physikalisch funktioniert, folgt im Abschnitt “Physikalische Ursachen des Phasenwinkels”.
Die elektrische Feldstärke, hervorgerufen durch die Ladungsverteilung an den Membranen, erreicht enorme Werte. Nimmt man für das Membranpotenzial 0.1 V und die Dicke der Zellmembran 10 nm, ergibt sich rein rechnerisch eine elektrische Feldstärke von ungeheuren 10⁷ V/m. In der unbelebten Natur würden solche Werte einen unverzüglichen Ladungsausgleich bewirken. An diesem Beispiel zeigt sich der qualitative Unterschied zwischen Belebtem und Unbelebtem.
Damit wird auch verständlich, warum der Phasenwinkel so eng mit der Vitalität verbunden ist. Die Abhängigkeit des Phasenwinkels vom Membranpotenzial als typisches Phänomen lebender Systeme bewirkt den engen Zusammenhang zur Vitalität.
Phasenwinkel und Überlebenswahrscheinlichkeit bei schweren Erkrankungen
Als Nächstes betrachten wir nun den Zusammenhang zwischen Phasenwinkel und praktischen Phänomenen, die man spontan mit dem Begriff der Vitalität verbindet: Überlebenswahrscheinlichkeit bei schweren Krankheiten und danach körperliche Leistungsfähigkeit.
Wer schon länger mit der bioelektrischen Impedanzanalyse arbeitet, kennt die praktische Bedeutung des Phasenwinkels. Fast immer zeigt ein steigender Wert physiologisch erwünschte, ein sinkender Wert unerwünschte Veränderungen der Muskeln und Organe.
Die folgenden Berichte über den Einfluss des Phasenwinkels auf die Gesundheit oder die Wahrscheinlichkeit eine Krankheit zu überleben, beziehen sich auf statistische Daten. Das erlaubt keine sicheren Aussagen im Einzelfall. Der Wert des Phasenwinkels hängt auch vom Körpertyp ab. So haben z.B. schlanke Menschen physiologisch bedingt oft einen deutlich niedrigeren Phasenwinkel, ohne dass damit gesundheitliche Einschränkungen verbunden sein müssen. Wichtiger ist die Betrachtung der zeitlichen Änderung des Phasenwinkels.
Seit mehreren Jahrzehnten erforscht man im klinischen Alltag den Zusammenhang zwischen Phasenwinkel und Überlebenswahrscheinlichkeit schwerer Krankheiten. Die Ergebnisse dieser Forschung zeigen bei verschiedenen Erkrankungen eine überraschende prognostische Kraft der wichtigsten Messgröße der BIA. Eine Übersicht zu diesem Forschungsgebiet liefert [Garlini2019].
Phasenwinkel und Überlebenswahrscheinlichkeit bei Darmkrebs
Ein Beispiel für die Abhängigkeit der Überlebenswahrscheinlichkeit vom Phasenwinkel zeigt folgende Grafik aus [Gupta2004].

Die obere Abbildung gibt die Überlebenswahrscheinlichkeit von Patienten mit Darmkrebs (genauer kolorektales Karzinom) an. Der Phasenwinkel wurde direkt nach dem Erkennen der Erkrankung bestimmt. Die gestrichelte Linie zeigt den Verlauf der Überlebenswahrscheinlichkeit bei Patienten mit einem Phasenwinkel ≤5,57. Die durchgezogene Linie für solche mit Phasenwinkel >5,57. Jeder Abfall in einer Wahrscheinlichkeitskurve bedeutet einen oder mehrere Sterbefälle. Die vertikalen Linien zeigen Patienten, die das Ende der Nachbeobachtungszeit erreicht haben, ohne zu sterben. Während nach 20 Monaten in der Gruppe mit höherem Phasenwinkel noch 85 % der Patienten lebten, waren es in der Gruppe mit niedrigerem Phasenwinkel nur noch 21 %.
Die Auswertung der Daten [Gupta2004] ergab für die Gruppe mit Phasenwinkel >5,57° einen Median der Lebenserwartung von 40,4 Monaten im Vergleich zu nur 8,6 Monaten für die Gruppe mit niedrigerem Phasenwinkel. Der Unterschied in der Lebenserwartung war hochsignifikant.
Phasenwinkel und Überlebenswahrscheinlichkeit bei Covid-19
Ein zweites Beispiel zum Zusammenhang zwischen Phasenwinkel und Überlebenswahrscheinlichkeit wurde in [Cornejo-Pareja2021] bei Patienten mit Covid-19 untersucht. Das Ziel der Studie bestand in Klärung der Voraussagekraft des Phasenwinkels zur 90 Tage Überlebenswahrscheinlichkeit bei Covid-19 Patienten.
Zusätzlich zum Phasenwinkel (PhA) wird noch ein sogenannter standardisierter Phasenwinkel (SPhA) eingeführt. Beide prognostizierten signifikant die Überlebenswahrscheinlichkeit der Patienten. Der “gewöhnliche” Phasenwinkel tat dies mit einer Irrtumswahrscheinlichkeit von p=0.001, beim abgeleiteten Wert SPhA lag die Irrtumswahrscheinlichkeit bei p=0.005, also Faktor 5 schlechter.
Insgesamt bezog man 127 Patienten in die Studie ein. Die folgende Grafik aus [Cornejo-Pareja2021] fasst die Ergebnisse anschaulich zusammen.

Obere Abbildung zeigt die Wahrscheinlichkeit, Covid-19 zu überleben. Die BIA-Messung erfolgte innerhalb von 72 h nach Ankunft im Krankenhaus. Die Patienten teilte man in vier Gruppen. Gruppe Q1 — in der obigen Abbildung blau eingezeichnet — mit dem niedrigsten SPhA ≤ ‑2 (2° ≤ PhA ≤ 3.3°) wies im Beobachtungszeitraum von 90 Tagen die niedrigste Überlebenswahrscheinlichkeit auf. In dieser Gruppe starben mehr als 30 % der Patienten.
Die Gruppen Q2 (gelb) mit ‑1.9 ≤ SPhA ≤ ‑0.8 (3.3° < PhA ≤ 4.4°) und Q3 (grün) mit ‑0.7 ≤ SPhA ≤ 0.2 (4.4° < PhA ≤ 5.7°) wiesen mit weniger als 10 % bereits eine deutlich geringere Sterblichkeit auf. In der Gruppe Q4 (rot) mit SPhA > 0.3 (PhA > 5.7°) überlebten alle Patienten den Beobachtungszeitraum von 90 Tagen.
Zusammenhang zwischen Phasenwinkel und leichterem Krankheitsverlauf ist typisch
Inzwischen gibt es hunderte wissenschaftliche Studien [Garlini2019] zum Zusammenhang zwischen Phasenwinkel und Überlebenswahrscheinlichkeit. Darin werden verschiedenste Krankheiten betrachtet. Von bösartigen Tumoren bis hin zu Infektionskrankheiten weist der Phasenwinkel eine beeindruckende Prognosekraft auf. Je höher der Phasenwinkel zu Beginn einer Krankheit, desto wahrscheinlicher ist ein leichter Verlauf.
Dabei handelt es sich beim Phasenwinkel um eine einfache elektrische Messgröße, die zusammen mit der Resistanz den elektrischen Wechselstromwiderstand eines Körpers charakterisiert. Die praktischen Beobachtungen scheinen zu bestätigen, dass der Phasenwinkel ein Indikator der Vitalität ist. Doch warum ist das so? Eine plausible Antwort versucht der letzte Abschnitt dieses Artikels zu den physikalischen Ursachen des Phasenwinkels zu geben.
Phasenwinkel und körperliche Leistungsfähigkeit
Der Zusammenhang zwischen Phasenwinkel und Vitalität zeigt sich auch deutlich bei sportlicher und körperlicher Leistungsfähigkeit. Dazu gibt es inzwischen ebenfalls einige hundert Studien. Ein typisches Beispiel ist die Veröffentlichung [Martins2021], die mit jugendlichen, männlichen Fußballspielern durchgeführt wurde. Die beiden folgenden Abbildungen aus dieser Publikation illustrieren typische Zusammenhänge zwischen Phasenwinkel und Sprungweite bzw. Schnelligkeit beim Sprint.
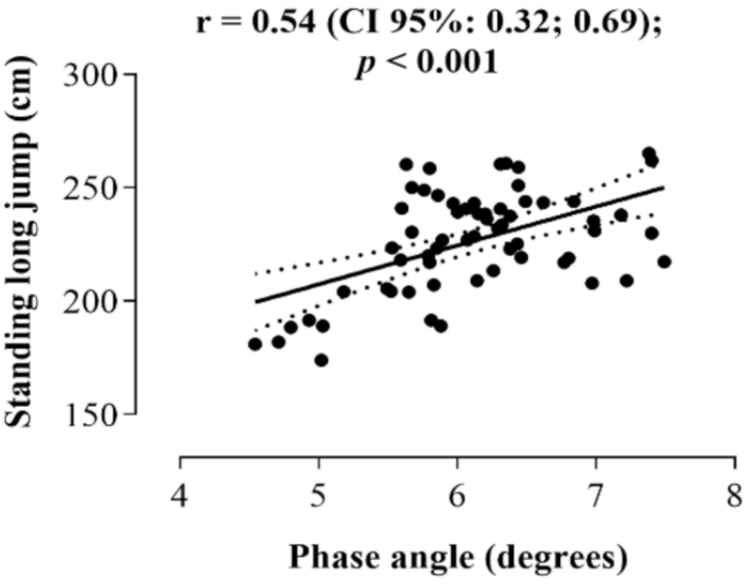
Die Abbildung oben zeigt die individuellen Messpunkte der 62 Studienteilnehmer nach einem Sprungtest aus dem Stand (standing long jump — SLJ) in Abhängigkeit vom Phasenwinkel. Der statistische Zusammenhang ist klar erkennbar.

Im Bild wird die Zeitdauer für einen 30 m Sprint als Funktion des Phasenwinkels dargestellt. Je höher der Phasenwinkel, desto kürzer ist die Zeitdauer zur Überwindung der 30 Meter bzw. desto höher ist die Geschwindigkeit der Sportler. Der Effekt ist hier noch ausgeprägter.
Physikalische Ursachen des Phasenwinkels
Anschauliche Beschreibung elektrischer Leitungsvorgänge im Lebendigen
Was passiert, wenn ich ein elektrisches Feld (Wechselspannung) an eine Suspension von lebenden Zellen oder ein Lebewesen anlege? Grundsätzlich wirken auf Ladungen in diesem elektrischen Feld Kräfte. Die Modelle, die nun diese Effekte beschreiben, können unterschiedlich detailgetreu sein.
D.h. das einzig richtige Modell gibt es nicht. Für den Einstieg betrachte ich deshalb erst einmal ein sehr einfaches physikalisches Modell.
Wird im Rahmen einer BIA-Messung eine Wechselspannung an einen lebenden Organismus angelegt, erzeugt dieses elektrische Feld Kräfte auf geladene Moleküle und Strukturen. Zu diesen gehören:
- Ionen (Anionen, Kationen)
- induzierte Ladungen — diese entstehen erst im Feld
- Wassermoleküle, Proteine (Dipole bzw. Multipole)
- ungeladene Zellbestandteile mit anderer Permittivität und Leitfähigkeit als die mikroskopische Umgebung (Maxwell-Wagner-Effekt — [Wagner1914])
- geladene Zellbestandteile (z.B. Zellmembran, Mitochondrien)
Durch diese Kräfte, verursacht durch die elektrische Wechselspannung, schwingen die elektrisch geladenen Objekte hin und her. Freie Ionen in wässriger Lösung, werden nur unwesentlich durch andere geladene Objekte beeinflusst. Die Ionen schwingen im Takt der Wechselspannung, definiert durch die Reibung zwischen den Ionen und dem umgebenden Wasser. Der elektrische Strom aus Ladungen erreicht dann sein Maximum, wenn auch die antreibende Kraft durch die elektrische Wechselspannung ihr Maximum erreicht.
Daneben wirken auch noch Kräfte auf die Wassermoleküle. Diese sind zwar als Ganzes elektrisch neutral, jedoch weist jedes Wassermolekül ein inhomogene Ladungsverteilung auf. Diese führt zu Polarisationseffekten der Wassermoleküle. Es gibt in diesem Fall bereits eine kleine Verschiebung zwischen Strom und Spannung, also eine kleine Phasenverschiebung.
Einflüsse größerer Zellbestandteile mit unterschiedlichen elektrischen Eigenschaften
Sind zusätzlich ungeladene Lipidmembranen oder ähnliche Objekte vorhanden, treten weitere Effekte auf. Wird von außen ein elektrisches Feld eingeschaltet, treffen Ladungsträger in ihrer Schwingbewegung wechselseitig auf diese größeren Zellbestandteile. Im Vergleich zu Ionen sind diese Bestandteile sehr große Objekt und verändern bedingt durch Trägheit und Reibung ihre räumliche Position viel weniger.
Das führt dazu, dass nachfolgende, gleichartig geladene Ionen von den bereits gestauten Ionen abgestoßen werden und den “Stau” vergrößern. Die Folge davon ist die periodische Aufladung bzw. Umladung an der Oberfläche der Zellbestandteile.
Noch bevor die Kräfte durch die Wechselspannung ihr Maximum erreichen, nimmt der Strom aus Ladungen wieder ab, da diese durch die gleichartig geladenen Ionen an der Membran mit einer zunehmenden Gegenkraft abgestoßen werden. So kommt es zu einer Verschiebung zwischen Strom und Spannung (Phasenwinkel). Der Strom aus Ladungsträgern erreicht daher das Maximum früher als die Spannung des äußeren elektrischen Feldes.
Der soeben beschriebene Effekt, bei dem ungeladene Lipidmembranen im elektrischen Wechselfeld aufgeladen werden, ist ein spezieller Fall des sogenannten Maxwell-Wagner-Effekts. Dieser tritt bei angrenzenden Objekte mit unterschiedlicher Permittivität und Leitfähigkeit auf. Eine gute Erklärung am Beispiel heterogener Schichten findet sich in [Li2021]. Die erste quantitative Modellierung dieses Effekts erfolgte in [Wagner1914].
Einflüsse geladener Lipidmembranen auf die Phasenverschiebung
Doch was passiert, wenn Membranen wie z.B. bei Mitochondrien oder Zellen bereits elektrisch geladen sind? Dann treten weitere Effekte auf, die die Verschiebung zwischen der Wechselspannung und dem Strom, also den Phasenwinkel erheblich vergrößern.
Allgemein gesprochen ermöglichen diese elektrisch geladenen Membranen die periodische Speicherung und Abgabe von Energie als elektrostatische und mechanische Energie im elektrischen Wechselfeld. (Diese energetische Sichtweise ist z.B. auch beim Maxwell Wagner Effekt anwendbar.) Mechanismen der Zwischenspeicherung sind z.B. die Verschiebung von Ladungen und die periodische Deformation von Membranen. Diese Prozesse benötigen jedoch, bedingt durch die endliche Geschwindigkeit und die Trägheit, etwas Zeit und verursachen dadurch eine zeitliche Verschiebung zwischen Strom und Spannung, die Phasenverschiebung bzw. den Phasenwinkel.

Wenn ein elektrisches Wechselfeld angelegt wird, deformiert sich also die Ladungsverteilung an der Membran. Parallel wachsen die Abstoßungskräfte zwischen den gleichartigen Ladungen. Gleichartige negative Ladungen sind innerhalb, die positiven Ladungen hingegen außerhalb. Dadurch kommt es zu einer zusätzlichen Anziehung zwischen den Ladungsverteilungen Innen und Außen. Bedingt durch die nichtleitende Lipidmembran, ist ein Ausgleich nicht möglich.
In schwachen elektrischen Feldern, d.h. bei kleinen Spannungen oszillieren die “Ladungswolken” hin und her und bilden damit einen Teil des elektrischen Stromes. Durch die Trägheit und Gegenkräfte erreicht der Strom der Ladungen früher sein Maximum als die Spannung und bewirkt so eine erhebliche Phasenverschiebung und Permittivität [Prodan2008].
Der dominierende Faktor ist das Membranpotenzial
Je größer das Membranpotenzial, desto stärker ist dieser Effekt. Bei Frequenzen bis zu einigen 10 kHz sind die Membranpotenziale die dominierende Ursache für die Phasenverschiebung [Prodan1999].
Doch wie groß sind Effekte der Membranpotenziale verglichen mit denen des Maxwell-Wagner Effekts in z.B. lebendem Muskelgewebe? Die direkte Messung ist nicht so einfach möglich, da die Membranpotenziale nicht aus und wieder eingeschaltet werden können. Es gibt allerdings Suspensionen aus Phospholipid-Vesikeln, die ähnliche physikalische Eigenschaften wie lebende Zellen aufweisen. An diesen erfolgten Messungen der Permittivität.


Das erste Bild zeigt die Permittivität für Muskelgewebe in Abhängigkeit der Frequenz [Schwan1954]. Im Vergleich dazu ist im zweiten Bild eine vergleichbare Messung mit einer Suspension aus Phospholipid-Vesikeln dargestellt [Schwan1970]. Die Probe wies einen Volumenanteil von 14 % Vesikeln auf.
In lebendem Gewebe liegt der Zellanteil typischerweise Faktor 4 höher (statt 14 % eher > 50 %). Vergleicht man die Permittivität — und damit indirekt den Phasenwinkel — z.B. bei 10 kHz, so ergibt sich beim Muskelgewebe ein Wert von etwa 10⁵ in der Suspension von Vesikeln hingegen nur 250. Unter Berücksichtigung des Faktor 4 kommt man auf hundertmal höhere Werte für lebendes Gewebe. Bei niedrigeren Frequenzen wird dieser Effekt noch größer, bei höheren Frequenzen hingegen kleiner.
Bestimmung des Membranpotenzials von Bakterien
Den dominierenden Einfluss des Membranpotenzials auf den Phasenwinkel nutzt man seit einigen Jahren, in der mikrobiologischen Forschung. So bestimmte man in [Bot2009], aus der Messung der Permittivität bei verschiedenen Frequenzen von Proben mit lebenden Zellen (E‑coli Suspension) Änderungen in deren Membranpotenzial. Inzwischen gibt es eine knapp dreistellige Zahl von Arbeiten, die dieses Modell zur Bestimmung des Membranpotenzials bei Bakterien praktisch anwenden.
Das oben beschriebene Modell erfasst sehr gut die Situation bei Bakterien. Diese haben im Gegensatz zu unseren Zellen keine Mitochondrien. Nach meinem aktuellen Kenntnisstand gibt es noch keine veröffentlichten theoretischen Modelle, die zusätzlich die Effekte von Mitochondrien oder anderen geladenen Zellkompartimenten berücksichtigen.
Interessanterweise ist die experimentelle Untersuchung der Vitalität von Mitochondrien mithilfe der Impedanzmessung, insbesondere des Phasenwinkels, heute schon etabliert [Padmaraj2014], [Chakraborty2015]. Daher sind die Membranpotenziale der Mitochondrien physiologisch wahrscheinlich ähnlich bedeutsam wie die der Zellen. Das Folgende gilt deshalb auch für Mitochondrien.
Phasenwinkel, Vitalität und Körperwasser
Bei der bioelektrischen Impedanzanalyse am Menschen wird das Ergebnis der Messung vor allem durch die Muskeln der Arme und Beine bestimmt. Die folgende Abbildung zeigt die Situation an Gewebe. Dieses ist rechts und links mit kleinen Elektroden kontaktiert. Dazwischen befindet sich die Probe.

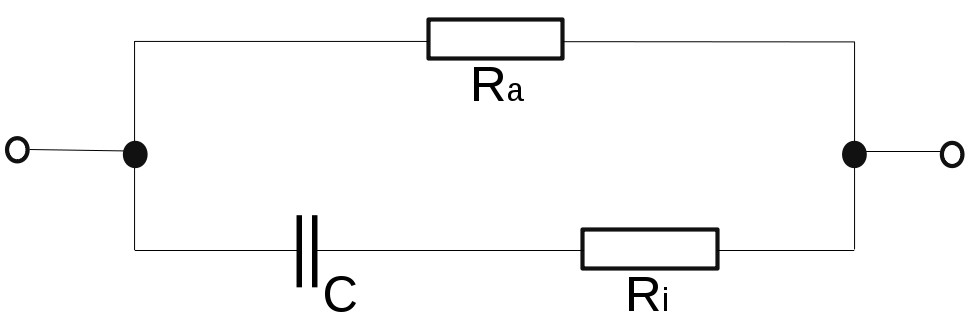
Der Strom durch das extrazelluläre Körperwasser weist nur eine kleine Verschiebung zur Spannung auf. Der intrazelluläre Strom hat durch die Wechselwirkung mit den Membranen hingegen einen viel größeren Phasenwinkel. D.h. je höher der Anteil des extrazellulären Wassers und damit des Stromes durch den extrazellulären Bereich, desto geringer ist der Phasenwinkel.
So können z.B. Entzündungsprozesse und Herzschwäche durch Erhöhung des extrazellulären Wassers den Phasenwinkel reduzieren.
Schlussfolgerung
Verschiedene Faktoren beeinflussen den Phasenwinkel. Dazu gehören vor allem die Membranpotenziale und das Verhältnis von extrazellulärem zu intrazellulärem Wasser.
Membranpotenziale werden durch komplexe, an Proteine gekoppelte biochemische Prozesse erzeugt. Dafür muss ständig Energie in Form von ATP aufgewendet werden. Faktoren, die die ATP-Produktion und Proteinsynthese behindern, wie z.B. Durchblutungsstörungen oder Mangel an Nähr- und Vitalstoffen reduzieren den Phasenwinkel.
Für ein hohes Membranpotenzial benötigt die lebende Zelle viel Energie (ATP), eine intakte Zellmembran und funktionsfähige Proteine. So können Krebszellen beispielsweise nur sehr wenig Energie bereitstellen und weisen daher ein sehr geringes Membranpotenzial auf.
Verringerung von extrazellulärem und Erhöhung von intrazellulärem Wasser z.B. durch Muskelaufbau und Reduktion von Entzündungsprozessen erhöhen den Phasenwinkel. D.h. auch eine physiologisch ungünstige Wasserverteilung im Körper reduziert den Phasenwinkel.
Daraus folgt, dass der Phasenwinkel ein praxisrelevanter Indikator für die Vitalität der Zellfunktionen ist.
Literatur
[Bot2009]: Bot, Corina, and Camelia Prodan. “Probing the membrane potential of living cells by dielectric spectroscopy.” European Biophysics Journal 38.8 (2009): 1049–1059.
[Chakraborty2015]: Chakraborty Mitra, Rooplekha. PROBING TEMPORAL CHANGES IN MITOCHONDRIAL MEMBRANE POTENTIAL WITH IMPEDANCE SPECTROSCOPY. Diss. 2015.
[Cornejo-Pareja2021]: Cornejo-Pareja, Isabel, et al. “Phase angle and standardized phase angle from bioelectrical impedance measurements as a prognostic factor for mortality at 90 days in patients with COVID-19: A longitudinal cohort study.” Clinical Nutrition (2021).
[Driesch1905]: Driesch, Hans. Der Vitalismus als Geschichte und als Lehre. Vol. 3. Johann Ambrosius Barth, 1905.
Foster1996]: Foster, Kenneth R., and Henry C. Lukaski. “Whole-body impedance–what does it measure?.” The American journal of clinical nutrition 64.3 (1996): 388S-396S.
[Fujii2020]: Fujii, Katsunori, and Yuki Takeyama. “Advantages of Phase Angle in Evaluating Physical Vitality Level.” American Journal of Sports Science 8.3 (2020): 56–61.
[Garlini2019]: Garlini, Luíza M., et al. “Phase angle and mortality: a systematic review.” European journal of clinical nutrition 73.4 (2019): 495–508.
[Gupta2004]: Gupta, Digant, et al. “Bioelectrical impedance phase angle in clinical practice: implications for prognosis in advanced colorectal cancer.” The American journal of clinical nutrition 80.6 (2004): 1634–1638.
[Li2021]: Li, Changsheng, et al. “A direct proof for Maxwell–Wagner effect of heterogeneous interface.” AIP Advances 11.6 (2021): 065227.
[Martins2021]: Martins, Priscila Custódio, et al. “Phase angle is related to 10 m and 30 m sprint time and repeated-sprint ability in young male soccer players.” International Journal of Environmental Research and Public Health 18.9 (2021): 4405.
[Padmaraj2014]: Padmaraj, Divya, et al. “Mitochondrial membrane studies using impedance spectroscopy with parallel pH monitoring.” PLoS One 9.7 (2014): e101793.
[Prodan1999]: Prodan, Camelia, and Emil Prodan. “The dielectric behaviour of living cell suspensions.” Journal of Physics D: Applied Physics 32.3 (1999): 335.
[Prodan2008]: Prodan, Emil, Camelia Prodan, and John H. Miller Jr. “The dielectric response of spherical live cells in suspension: an analytic solution.” Biophysical journal 95.9 (2008): 4174–4182.
[Schrodinger1951]: Schrodinger, Erwin. What is life? The physical aspect of the living cell. At the University Press, 1951.
[Schwan1954]: Schwan, Herman. “Die elektrischen Eigenschaften von Muskelgewebe bei Niederfrequenz.” Zeitschrift für Naturforschung B 9.4 (1954): 245–251.
[Schwan1970]: Schwan, H. P., et al. “Electrical properties of phospholipid vesicles.” Biophysical Journal 10.11 (1970): 1102–1119.
[Wagner1914]: Wagner, Karl Willy. “Erklärung der dielektrischen nachwirkungsvorgänge auf grund maxwellscher vorstellungen.” Archiv für Elektrotechnik 2.9 (1914): 371–387.
